發布時間:2020-04-29所屬分類:醫學論文瀏覽:1次
摘 要: 摘要分別以1,6-己二胺和對苯二胺為原料,與對映體純L-纈氨酸發生縮合進而得到手性氨基酚化合物。所合成氨基酚及相應的中間產物經過高分辨質譜、核磁共振氫譜和核磁共振碳譜等進行表征并確認結構。此外,化合物2A和7B-1通過X-ray單晶衍射法確定了結構。 關鍵
摘要分別以1,6-己二胺和對苯二胺為原料,與對映體純L-纈氨酸發生縮合進而得到手性氨基酚化合物。所合成氨基酚及相應的中間產物經過高分辨質譜、核磁共振氫譜和核磁共振碳譜等進行表征并確認結構。此外,化合物2A和7B-1通過X-ray單晶衍射法確定了結構。
關鍵詞氨基酚,合成,單晶
1.引言隨著藥物化學的不斷發展,使用催化法實現手性合成已經成為十分普遍的方法。迄今為止,過渡金屬催化劑、酶、有機小分子催化劑等被廣泛使用[1][2][3],特別是近幾年來迅速發展起來的手性有機小分子催化劑,因其具有容易制備、價格低廉、對環境友好、反應條件溫和等優勢而受到科學家們的青睞,成為研究的熱點和前沿[4]。
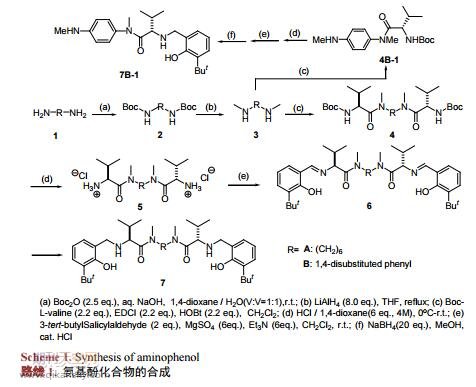
氨基酚化合物,其結構中含有氨基及酚羥基兩個官能團,它不僅可以作為配體與金屬Ti、Cu等絡合后參與反應,也可以單獨作為一種雙功能有機小分子催化劑使用,其在催化氰基對環氧化合物[5][6]以及亞胺[7][8]的不對稱加成、Mannich反應[9]、亞胺的烯丙基化反應[10][11][12]等多種反應中都表現出良好催化活性,相應反應都獲得較高的產率和對映選擇性。同時,這類催化劑擁有突出的優勢:易于合成,方便提純,催化劑用量少等。因而,合成新穎結構的氨基酚化合物具有重要的意義。本文設計合成了三種手性氨基酚化合物(7A,7B,7B-1),化合物7A和7B分別為含有鏈式和芳基對稱結構的氨基酚化合物,化合物7B-1為含有苯胺結構的氨基酚化合物。氨基酚化合物的合成如路線1所示。
2.實驗方法
2.1.主要試劑及儀器
INOVA-600型核磁共振儀(以TMS為內標,CDCl3為溶劑);BruckerEquinox55FT-TR型紅外光譜儀(KBr壓片);Brucker型質譜儀(ESI電離技術);低溫實驗使用EYELAPSL-1810型磁力攪拌低溫恒溫水槽(無水乙醇為介質)。
實驗所用試劑均為分析純,石油醚沸程為60℃~90℃,其中,無水四氫呋喃是在鈉砂中惰性氣體保護下加熱回流并用二苯甲酮顯色;柱層析硅膠G(青島海洋化工有限公司);薄層層析硅膠GF254(青島海洋化工有限公司);薄層層析板(GF254,加0.5%CMC自制),紫外燈下(254nm)觀測并用碘蒸氣顯色。
2.2.氨基酚化合物的合成
以化合物7A的合成為例[10]:
50mL圓底瓶中加入化合物1A(0.23g,2mmol),添加混合溶劑(20mL,V1,4-二氧六環:V水=1:1)攪拌使其溶解溶液。冰浴條件下分批加入(Boc)2O(1.09g,5mmol,2.5equiv.),同時緩慢滴加10%的NaOH溶液,使PH保持在8~9之間。待酸酐加畢,混合液室溫攪拌過夜,TLC監測反應。用乙酸乙酯(20mL×3)萃取,水相用10%的KHSO4溶液酸化至PH=2~3后,用乙酸乙酯萃取水相,合并有機相,無水Na2SO4干燥,過濾,濾液濃縮得到粗產物。粗產物經乙酸乙酯重結晶,得化合物2A。
50mL圓底瓶中加入無水THF,冰浴下加入LiAlH4(0.61g,16mmol,8.0equiv.),緩慢加入2A(0.63g,2mmol),Ar保護下回流4h,TLC監測反應。在冰浴條件下,緩慢加入Na2SO4水溶液淬滅反應,過濾,乙酸乙酯洗滌固體,合并有機相,濃縮得粗產物。減壓蒸餾純化(b.p.70℃,壓力44Pa)得無色液體3A。
EDCI(0.17g,0.92mmol,2.2equiv.)、CH2Cl2(20mL)、HOBT(0.12g,0.92mmol,2.2equiv.)、Boc-L-纈氨酸(0.20g,0.92mmol,2.2equiv.)順序加入50mL圓底瓶中,攪拌溶解。將3A(0.06g,0.42mmol)溶解在CH2Cl2中,逐滴加入到上述混合溶液中,室溫攪拌,TLC監測反應。反應完畢,于反應體系中加入10wt%的檸檬酸(20mL),攪拌,將析出的白色沉淀物過濾,濾液用10wt%的檸檬酸(20mL)、飽和NaHCO3、飽和食鹽水洗滌,合并有機相,無水Na2SO4干燥,過濾,濃縮得粗產物。快速柱層析(PE:EA=2:1)得無色油狀液體4A,直接進行下一步反應。
50mL圓底瓶中加入4A(0.13g,0.24mmol),冰浴攪拌下加入鹽酸的1,4-二氧六環溶液(4.0M,2.88mmol,0.72mL,12equiv.),緩慢升至室溫攪拌反應,1.5h后往反應體系中充入30min氮氣,減壓濃縮,得到棕褐色粘稠液體5A,不經純化直接進行下一步反應。
氬氣保護下,在含5A的50mL圓底瓶中加入3-叔丁基水楊醛(0.11g,0.6mmol,2.5equiv.)、無水MgSO4(0.17g,1.44mmol,6.0equiv)、CH2Cl2(20mL)、Et3N(0.15g,1.44mmol,2.0mL,6.0equiv.),室溫攪拌反應過夜,TLC監測反應。反應完畢,將亮黃色固液混合物用短硅膠柱過濾以除去MgSO4和三乙胺鹽酸鹽,硅膠柱用石油醚/乙酸乙酯(2:1)洗脫至淋洗液無色,洗脫液減壓濃縮得黃色油狀物,用正己烷多次洗滌黃色油狀物以除去殘留的三乙胺鹽酸鹽,濾液合并,減壓濃縮得亮黃色油狀液體6A。
在含有化合物6A(0.18g,0.27mmol)的圓底燒瓶中加入甲醇(25mL),冰浴攪拌下先后加入NaBH4(0.10g,2.7mmol)和一滴鹽酸,伴隨氣體產生的同時溶液由黃色變為無色,繼續冰浴攪拌30min。緩慢加入稀鹽酸溶液(2.0M)直至反應體系pH<1,以除去反應體系中多余的還原劑。反應體系用CH2Cl2(20mL×3)萃取,合并有機相,無水Na2SO4干燥,過濾,減壓濃縮。所得固體用CH2Cl2/正己烷(1:8)重結晶得化合物7A。
推薦閱讀:藥理學醫生怎么發表論文
3.結果與討論
3.1.二胺的甲基化反應
伯胺的甲基化反應可用甲醛、硫酸二甲酯、碳酸二甲酯、甲醇等為甲基化試劑實現,但上述試劑參與的反應較難控制在單甲基化反應階段。相比直接甲基化法,酰胺還原法在伯胺的單甲基化中有較好的應用。本論文采用Boc保護氨基,通過控制Boc2O用量、加料順序和速度等可很好的抑制單邊伯胺的雙Boc等副反應,得到較好產率的化合物2A。再用LiAlH4氫化酰胺,可方便的在伯胺上引入一個甲基,得到化合物3A。化合物2A的單晶(圖1)可通過乙酸乙酯重結晶獲得。化合物3A的純化可通過減壓蒸餾(b.p.70℃,44Pa)實現。
3.2.氨基酚化合物的合成
由1,6-己二胺出發,經氨基與Boc2O作用的酰胺化、LiAlH4對酰胺的還原、仲胺與纈氨酸衍生物的酰胺化、酸性條件脫除Boc、游離氨基與叔丁基水楊醛的縮合及還原等反應可成功獲得氨基酚化合物7A。但當以1,4-對苯二胺為原料時,在相同用料比的條件下,除得到了化合物4B和4B-1外,還分離純化得到化合物4B-2。經對反應機理[13][14]和相關文獻[15]的分析發現(路線2),化合物4B-2是L-纈氨酸在(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDCI)活化作用下與1-羥基苯并三氮唑(HOBT)的縮合產物。化合物4B-1和4B-2的形成可能是由于化合物4B-1結構中芳香胺的親核性較弱,使其較難進攻中間體化合物4B-2形成化合物4B。經研究發現,通過往反應體系中添加一定量的堿可促進化合物4B-1向化合物4B的轉化。最后,通過調整L-纈氨酸的用量和添加胺用量可獲得較高產率的化合物4B和4B-1。將化合物4B和4B-1進行后續反應,可分別得到化合物7B和7B-1。化合物7B-1的單晶(圖2)可通過在石油醚/乙酸乙酯的混合溶劑重結晶獲得。
3.3.化合物2A和7B-1的晶體描述
用R-AXISSPIDER的衍射儀上對化合物2A和7B-1的單晶進行測試,用石墨單色化的MoKα(λ=0.71073Å)輻射,對化合物2A在153(2)K溫度下在2.64˚≤θ≤24.99˚范圍內以ω-2θ掃描方式收集衍射數據。共收集到5447個衍射點,1562個獨立衍射點(R(int)=0.0499)。其中1420個可觀測點[I>2σ(I)]用于晶體結構解析,最終差值殘余電子密度的最高峰為0.289e∙A−3,最低峰為−0.287e∙A−3。對化合物7B-1,在153(2)K溫度下在2.65˚≤θ≤27.5˚范圍內以ω-2θ掃描方式收集衍射數據。共收集到12,770個衍射點,5123個獨立衍射點(R(int)=0.0357)。其中4778個可觀測點[I>2σ(I)]用于晶體結構解析,最終差值殘余電子密度的最高峰為0.14e∙A−3,最低峰為−0.16e∙A−3。化合物2A和7B-1的全部強度數據均經Lp因子校正,并做經驗吸收校正。晶體結構由直接法解出,全部非氫原子的坐標及各向異性參數經最小二乘修正,用SHELXL-97程序(產生CIF的程序名稱)對F2進行精修獲得非氫原子坐標及各向異性參數,氫原子由差值Fourier合成和理論計算得到,他們的坐標和各向同性溫度因子參與結構計算,但不參與修正。其晶體學數據列于表1。
4.中間體及產物表征
4.1.化合物2A
白色固體,收率89.2%;IR(KBr)/cm-1:3371(NH),1686(C=O);1HNMR(600MHz,CDCl3,ppm),δ:4.55(brs,2H,NH),3.03(m,4H,N-CH2),1.44(m,4H,CH2),1.42(s,18H,CH3),1.31(m,4H,CH2);13CNMR(150MHz,CDCl3,ppm),δ:156.1(C=O),79.1(CtBu),40.5(N-CH2),30.1(CH2),28.5(CH3tBu),26.4(CH2).HRMS(ESI)Calcd.forC16H32N2O4(M+H+):317.2396,Found:317.2537.131
4.2.化合物3A
無色液體,收率65.8%;1HNMR(600MHz,CDCl3,ppm),δ:2.45(m,4H,N-CH2),2.32(m,6H,N-CH3),1.38(m,4H,CH2),1.24(m,4H,CH2),0.89(brs,2H,NH);13CNMR(150MHz,CDCl3,ppm),δ:52.1(N-CH2),36.6(N-CH3),29.9(CH2),27.3(CH2).HRMS(ESI)Calcd.forC8H20N2(M+H+):145.1660,Found:145.1717.
4.3.化合物6A
亮黃色油狀液體,收率58.6%;1HNMR(600MHz,CDCl3,ppm),δ:13.55(brs,2H,OH),7.99(s,2H,N-CH),7.31(d,2H,J=7.6Hz,Ar-H),7.20(s,4H,Ar-H),6.98(d,2H,J=6.0Hz,Ar-H),6.78(t,2H,J=7.6Hz,Ar-H),3.67(d,2H,J=7.6Hz,CH=N),3.31(S,6H,N-CH3),2.43(m,2H,CHiPr),1.41(s,18H,CH3),0.96(d,6H,J=4.4Hz,CH3iPr),0.82(d,6H,J=4.0Hz,CH3iPr);HRMS(ESI)Calcd.forC40H62N4O4(M+H+):663.4805,Found:663.4641.
SCISSCIAHCI